Uno studio osservazionale retrospettivo su casi di sarcoma trattati con il Metodo Di Bella: razionalità ed efficacia – A retrospective observational study on cases of sarcoma treated with the Di Bella Method: rationale and effectiveness.
Codice: MDB004
Autore: Di Bella et al.
Data: 2022
Rivista: World Journal of Pharmaceutical Research 11(7):1219-1278
Argomento: dati clinici Metodo Di Bella
Accesso libero: si
DOI: http://dx.doi.org/10.20959/wjpr20227-24424
URL: https://wjpr.net/abstract_show/19625
BLOG: https://www.metododibellaevidenzescientifiche.com/2022/06/29/mdb004-di-bella-et-al-2022/
Parole chiave: Sarcoma; Fattore di crescita; Somatostatina; Melatonina; Acido retinoico; Vitamina D; vitamina E; prolattina; Metodo Di Bella; agonisti D2R.
Tumore: sarcomi
Traduzione: tradotto l’intero articolo ma con semplificazioni
Punti di interesse
● Generalità. I sarcomi sono un raro gruppo eterogeneo di tumori maligni di origine mesenchimale, che comprendono l’1% di tutte le neoplasie maligne negli adulti e il 12% dei tumori maligni pediatrici. Lo spettro istopatologico dei sarcomi è ampio, perché le cellule embrionali mesenchimali da cui emergono, hanno la capacità di maturare in muscolo scheletrico striato, tessuto adiposo, tessuto fibroso, osso e cartilagine.
L’eziologia dei sarcomi rimane in gran parte sconosciuta correlata a difetti genetici e fattori ambientali. I difetti genetici si dividono in difetti cariotipici semplici e difetti cariotipici complessi. I difetti cariotipici semplici consistono in traslocazioni cromosomiche specifiche della malattia che portano a una funzione genica (e proteica) anormale, che facilita lo sviluppo del sarcoma. Difetti cariotipici complessi, come complessi riarrangiamenti cromosomici, intervengono sui geni del ciclo cellulare causando instabilità genetica. I sarcomi generati in questo modo tendono a manifestarsi nei pazienti più anziani e hanno un’alta frequenza di mutazioni. Leiomiosarcoma, liposarcoma, angiosarcoma e osteosarcoma sono esempi di tali tumori. Leggi tutto
Sia i sarcomi dei tessuti molli che i sarcomi ossei sono trattati principalmente con chemioterapia neoadiuvante, resezione chirurgica e chemioterapia adiuvante. La chemioterapia è raramente un trattamento affidabile per l’efficace risoluzione della malattia. Nei sarcomi ossei, se l’intervento chirurgico non è seguito da una ricaduta della malattia, la sopravvivenza a cinque anni per la malattia localizzata è di poco superiore al 70%, mentre negli osteosarcomi metastatici e nei sarcomi di Ewing è di poco superiore al 20%. Nei sarcomi dei tessuti molli, la sopravvivenza a 5 anni dopo la diagnosi dipende dall’aggressività della malattia e dalla precocità della diagnosi, con tassi di sopravvivenza di poco superiori al 50%. Nella metà dei sarcomi dei tessuti molli, la malattia si presenta o diventa metastatica. La sede principale delle metastasi è il polmone. Nella malattia metastatica, la sopravvivenza è generalmente di circa 12 mesi.
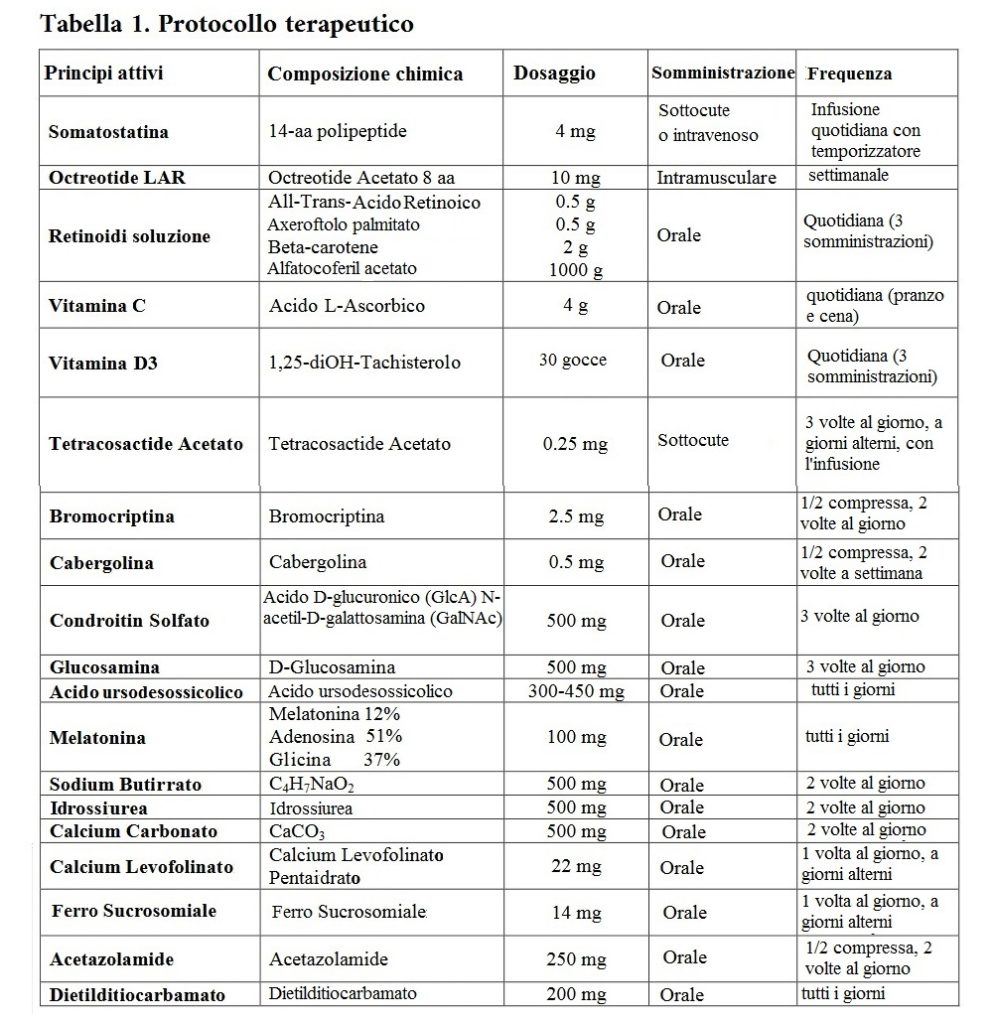
● Caratteristiche di questo studio e risultati. In questo studio osservazionale retrospettivo si è mostrato che i progressi nella terapia del sarcoma possono essere raggiunti con il Metodo DI Bella (MDB) in termini di risposta obiettiva, qualità della vita e sopravvivenza. Il protocollo di trattamento MDB è presentato in tabella 1. Sono stati analizzati 37 casi di sarcoma (dell’osso e dei tessuti molli) (tabella 2). Il trattamento ha migliorato significativamente la sopravvivenza e la qualità della vita nei pazienti affetti da sarcoma rispetto ai pazienti con sarcomi aventi caratteristiche immunoistochimiche, istologiche e cliniche simili (statistica oncologica) (tabella 3). La multiterapia prevede di 1) prevenire la proliferazione con Somatostatina e l’analogo dell’Octreotide, con inibitori della prolattina agonisti dei recettori dopaminergici D2 (D2R), 2) esercitare un’azione differenziante, citostatica, immunomodulante e antimetastatica utilizzando l’acido retinoico (ATRA), Beta-Carotene, Axeroftolo, solubilizzato in vitamina E, oltre alle vitamine D e C, Melatonina idrosolubile, Glucosamina e Condroitina solfato. L’idrossiurea è stata utilizzata a basse dosi metronomiche per indurre l’apoptosi.
● Razionale della terapia in breve. In vari sarcomi, la percentuale crescente di cellule staminali tumorali rispetto ai diversi fenotipi neoplastici di questi tumori è molto probabilmente la ragione principale per cui questi tumori acquisiscono rapidamente resistenza alla chemio-radioterapia, diventano molto aggressivi e progrediscono rapidamente. Fenomeni di proliferazione incontrollata e perdita di differenziazione, anche se in misura diversa, sono denominatori comuni a tutti i tumori.
La sintesi proteica e la proliferazione cellulare (normale e neoplastica) sono strettamente dipendenti dall’interazione della prolattina (PRL) con il più grande induttore di crescita, l’ormone della crescita (GH – Growth Hormone), e dalle molecole mitogeniche, fattori di crescita GH-dipendenti che sono positivamente da esso regolamentati, quali fattore di crescita epidermico (EGF), fattore di crescita fibroblastico (FGF), fattore di crescita degli epatociti (HGF), fattore di crescita simile all’insulina 1 (IGF1), fattore di crescita endoteliale vascolare (VEGF), fattore di crescita derivato dalle piastrine (PDGF), così come fattori di crescita gastrointestinali come peptide intestinale vasoattivo (VIP), polecistochinina (CCK) e la gastrina (G).
I recettori del GH (GHR)e della PRL (PRLR) sono co-espressi sulle membrane cellulari, hanno strutture simili, possono dimerizzare amplificando l’eterogeneità della risposta che il ligando può determinare legandosi ad essi. Numerosi studi indicano come questi ormoni ipofisari svolgano un ruolo cruciale nello sviluppo e nella progressione dei tumori umani. La loro espressione recettoriale è onnipresente e particolarmente elevata nel tessuto canceroso, con una relazione dose-dipendente tra l’espressione del recettore GH-PRL e i processi di induzione e progressione del tumore. La documentazione di concentrazioni di GHR molto più elevate nei tessuti tumorali rispetto ai tessuti normali e peritumorali conferma il suo potente ruolo mitogeno.
Questa evidenza spiega il motivo per cui il MDB utilizza somatostatina, analoghi e inibitori della prolattina per prevenire la proliferazione. I restanti componenti del Metodo hanno una funzione differenziante, immunomodulante e antiossidante. Il MDB supporta e potenzia le reazioni vitali e l’omeostasi antitumorale, aiutandole a contrastare l’insorgenza della neoplasia e la sua progressione. Nell’articolo viene spiegato in modo esteso, per ciascun principio attivo (tabella 1), il razionale scientifico dell’uso nel MDB nel trattamento dei sarcomi.
● Considerazioni finali. I pazienti con sarcoma e trattati con MDB hanno manifestato una tossicità rara e temporanea di modesta entità. Hanno mostrato un netto miglioramento in termini di sopravvivenza, risposta obiettiva e qualità della vita rispetto ai pazienti con sarcomi negli stessi stadi, con le stesse caratteristiche istochimiche, trattati con protocolli oncologici convenzionali.
Nella progressione dei sarcomi, come nella maggior parte dei tumori, la percentuale di cellule staminali tumorali, rispetto ad altre componenti della popolazione neoplastica, aumenta fino ad essere quasi totale ed è associata a chemio-radio-resistenza e rapida progressione. Per questo motivo deve essere fatto uso di molecole a opportuni dosaggi che la letteratura scientifica documenta per regolare negativamente le cellule staminali tumorali, come la melatonina, l’acido retinoico, la glucosamina, che migliorano la differenziazione e la riprogrammazione delle cellule staminali tumorali, regolando invece negativamente la loro proliferazione, invasività e resistenza.
A differenza dei protocolli oncologici, la somministrazione metronomica dell’agente chemioterapico idrossiurea nel MDB ha consentito un migliore controllo della proliferazione e dell’invasività delle cellule tumorali in assenza di mielotossicità, grazie alle proprietà mieloprotettive di 100 mg al giorno di melatonina idrosolubile e circa 25 ml di soluzione retinoide in vitamina E.
L’effetto antiproliferativo e antiangiogenico è stato aumentato dalla combinazione di somatostatina con la somministrazione intramuscolare di octreotide a lento rilascio consentendo la saturazione recettoriale e temporale. Il MDB, a differenza della concezione oncologica convenzionale, sposta l’azione terapeutica dai meccanismi citolitici tossici e immunodepressivi al contrasto della crescita neoplastica, diminuendo il livello ematico di GH, che attiva l’oncogenesi attraverso molteplici meccanismi. Gli attuali paradigmi oncologici iniziano ad ammettere che il cancro può essere considerato una ricapitolazione patologica dei processi di crescita.
Le componenti differenzianti del MDB, come la soluzione di retinoidi in vitamina E, Vitamine C, D e Melatonina, contrastano la capacità mutagena delle cellule tumorali, un vero e proprio sistema di difesa e programma di sopravvivenza che permette loro di riparare il danno al DNA indotto dalla chemio-radioterapia. Le prime forme di vita, i procarioti, sono sopravvissute fino ai giorni nostri perché si sono dotate di un sistema di difesa che ha permesso loro di riparare i danni al DNA causati da vari eventi avversi. I procarioti hanno trasmesso il programma di sopravvivenza ai batteri, che a loro volta lo hanno trasferito alle nostre cellule. È “programma SOS”, a cui anche le nostre cellule somatiche accedono per superare situazioni critiche. Questi meccanismi di difesa sono gli stessi attivati dalle cellule tumorali che attuano la stessa procedura dei batteri. Le cellule tumorali in una situazione di stress acuto implementano sistemi di riparazione del DNA ed esprimono o silenziano i geni in base alle loro esigenze, selezionando e conservando per ogni mutazione una serie di vantaggi. Allo stesso tempo, se il DNA di una cellula somatica è gravemente danneggiato, si attiva il percorso di sopravvivenza SOS per riparare il DNA, avviando così una serie di mutazioni che riparano ma allo stesso tempo modificano il DNA, iniziando il processo di cancerogenesi. La cellula inizia un’involuzione tumorale selezionando e conservando continuamente, con una progressione predefinita una serie di vantaggi, come confermato da diversi autori. E’ noto ormai che i vari approcci tradizionali contro le cellule tumorali, non solo la chemio e la radioterapia, ma anche gli anticorpi monoclonali e gli inibitori delle vie di segnalazione mitogeniche di fattori di crescita vari, possono attivare molto rapidamente il sistema SOS e un numero estremamente elevato di molteplici meccanismi di sopravvivenza.
I due obiettivi strategici della MDB, non ancora perseguiti dall’oncologia, sono 1) l’inibizione angiogenica proliferativa-invasiva neoplastica mediante Somatostatina/Octreotide, analoghi agonisti DR2, 2) la lotta contro la capacità mutagena del fenotipo neoplastico silenziando il sistema di sopravvivenza SOS e altri sistemi di sopravvivenza attraverso i componenti distintivi del MDB, con attività trofica, immunomodulante e antiossidante. Questi ultimi migliorano la vitalità e l’efficienza delle cellule sane ma riducono, contemporaneamente, l’efficienza, la vitalità e la funzionalità delle cellule neoplastiche. Le stesse molecole esercitano effetti opposti sulle cellule sane e neoplastiche. L’uso metronomico di principi attivi e dosi apoptotici, non citotossici, provoca lentamente ma progressivamente l’estinzione delle cellule tumorali per apoptosi.
In un tumore, anche le cellule staminali resistenti alla chemio-radioterapia svolgono un ruolo cruciale nel mantenimento della crescita del tumore e nell’inizio del processo metastatico. La chemioterapia e la radioterapia agiscono però sulle cellule tumorali a proliferazione attiva. Al contrario, le cellule staminali tumorali proliferano lentamente e non sono interessate da chemio e radioterapia. Per questo motivo, le attuali strategie terapeutiche non possono mantenere il controllo a lungo termine del processo tumorale.
Oggi, in assenza di valide alternative terapeutiche, i sarcomi sono caratterizzati da indici proliferativi e potenziale metastatico particolarmente elevati, con conseguente elevata mortalità. Le cause di questo drammatico fallimento sono: la totale insensibilità a tutti i protocolli oncologici di popolazioni di sarcomi costituite principalmente da cellule staminali tumorali su cui, al contrario, è stata dimostrata l’efficacia delle molecole MDB qui discusse; la capacità delle cellule di sopravvivere a terapie tossiche cambiando e selezionando genotipi e fenotipi favorevoli anche a trattamenti sfavorevoli alla loro crescita; la mancata somministrazione di melatonina e di somatostatina, inibitore fisiologico del GH (e dei relativi fattori di crescita) e, quindi, inibitore fisiologico della proliferazione e disseminazione neoplastica.
Non esiste (o esisterà mai) nessun trattamento chemioterapico citotossico (o monoterapia) in grado di guarire un tumore solido. Esiste solo un metodo, una multiterapia razionale e biologica, un complesso di sostanze sinergiche e fattorialmente interattive, individualmente dotate di attività antitumorale non tossica, che agiscono in modo sequenziale o simultaneo sulle miriadi di reazioni biologiche della vita tumorale, riportando gradualmente alla normalità la reazioni vitali alterate dal cancro.
Traduzione articolo
Riassunto
Nonostante tutti i nuovi sviluppi nella terapia del cancro, l’aspettativa di vita dei pazienti con sarcoma rimane breve. Da quando è stato istituito come terapia antitumorale, il Metodo Di Bella (MDB) è stato in grado di aumentare il tasso di sopravvivenza e la qualità della vita, senza tossicità manifesta, rispetto a quanto descritto in letteratura per il trattamento del sarcoma con lo stesso immunoistochimico, caratteristiche istologiche e cliniche. Abbiamo quindi trattato 37 pazienti con sarcoma utilizzando il protocollo MDB. La terapia MDB consiste in somatostatina e analoghi (octreotide), acido tutto trans-retinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, idrossiurea, butirrato di sodio (Na-Bu). Queste molecole hanno proprietà antiproliferative, antiangiogeniche, citostatiche, antiossidanti, antimetastatiche (differenziative) e immunomodulanti. Inoltre, l’inclusione di ATRA, MLT e Na-Bu ha aumentato le proprietà antitumorali della terapia estendendole alle cellule staminali tumorali. Inoltre, il dosaggio metronomico non citolitico e non citotossico di idrossiurea ha migliorato l’esito della terapia MDB aumentando la capacità antitumorale. I risultati di questo trattamento hanno rivelato l’efficacia del MDB. In conclusione, gli obiettivi multistrategici del MDB sono inibire la proliferazione-invasività e l’angiogenesi neoplastica, silenziare il sistema di sopravvivenza delle cellule staminali tumorali, potenziare le attività immunomodulatorie e antiossidanti, migliorare la vitalità e l’efficienza delle cellule normali e deprimere l’efficienza e vitalità di quelle neoplastiche. Leggi tutto
PREMESSA-INTRODUZIONE
I sarcomi sono un raro gruppo eterogeneo di tumori maligni di origine mesenchimale, che comprendono l’1% di tutte le neoplasie maligne negli adulti e il 12% dei tumori maligni pediatrici. Lo spettro istopatologico dei sarcomi è ampio, presumibilmente perché le cellule embrionali mesenchimali da cui emergono, hanno la capacità di maturare in muscolo scheletrico striato, tessuto adiposo, tessuto fibroso, osso e cartilagine. [1] Si dividono principalmente in sarcomi ossei e sarcomi dei tessuti molli. I primi sono meno comuni, con significativa eterogeneità morfologica e biologia ad ampio spettro [2], mentre il secondo tipo più comune comprende almeno 100 differenti sottotipi istologici e molecolari, con comportamento clinico variabile. [3] Mentre parte di questa eterogeneità intratumorale potrebbe essere spiegata in termini di evoluzione genetica clonale, una parte essenziale include una relazione gerarchica tra le cellule del sarcoma, governata da influenze sia genetiche che epigenetiche. La nozione di questa gerarchia funzionale operante all’interno di ciascun tumore implica l’esistenza di cellule staminali del sarcoma. Con evidenze progressive, la letteratura sta documentando, negli osteosarcomi, la stretta relazione causale tra il significativo aumento del tasso sierico di GH durante lo sviluppo e in età prepuberale e puberale, e il suo sito d’azione, chiaramente prevalente nelle aree di crescita osteocartilaginea. [4] Sia i sarcomi dei tessuti molli che i sarcomi ossei sono trattati principalmente con chemioterapia neoadiuvante, resezione chirurgica e chemioterapia adiuvante. La radioterapia viene utilizzata meno spesso e viene generalmente applicata quando altri trattamenti non possono ottenere risultati significativi. [1,2,3] Non esiste un trattamento unico per i singoli sottotipi di sarcoma dei tessuti molli a causa dell’ampio spettro biologico. Il trattamento varia a seconda dell’immunoistochimica del tumore. La chemioterapia è raramente un trattamento affidabile per l’efficace risoluzione della malattia. [1] Nei sarcomi ossei, dove l’intervento chirurgico non è seguito da una ricaduta della malattia, la sopravvivenza a cinque anni per la malattia localizzata è di poco superiore al 70%, mentre negli osteosarcomi metastatici e nei sarcomi di Ewing è di poco superiore al 20%. [3] Nei sarcomi dei tessuti molli, la sopravvivenza a 5 anni dopo la diagnosi dipende dall’aggressività della malattia e dalla precocità della diagnosi, con tassi di sopravvivenza di poco superiori al 50%. Nella metà dei sarcomi dei tessuti molli, la malattia si presenta o diventa metastatica. La sede principale delle metastasi è il polmone. Nella malattia metastatica, la sopravvivenza è generalmente di circa 12 mesi. [5]
Il nostro studio osservazionale retrospettivo ha mostrato che i progressi nella terapia del sarcoma possono essere raggiunti con il MDB in termini di risposta obiettiva, qualità della vita e sopravvivenza. I pazienti con sarcoma sono stati trattati con il seguente protocollo di trattamento MDB (Tab.1).
CASI
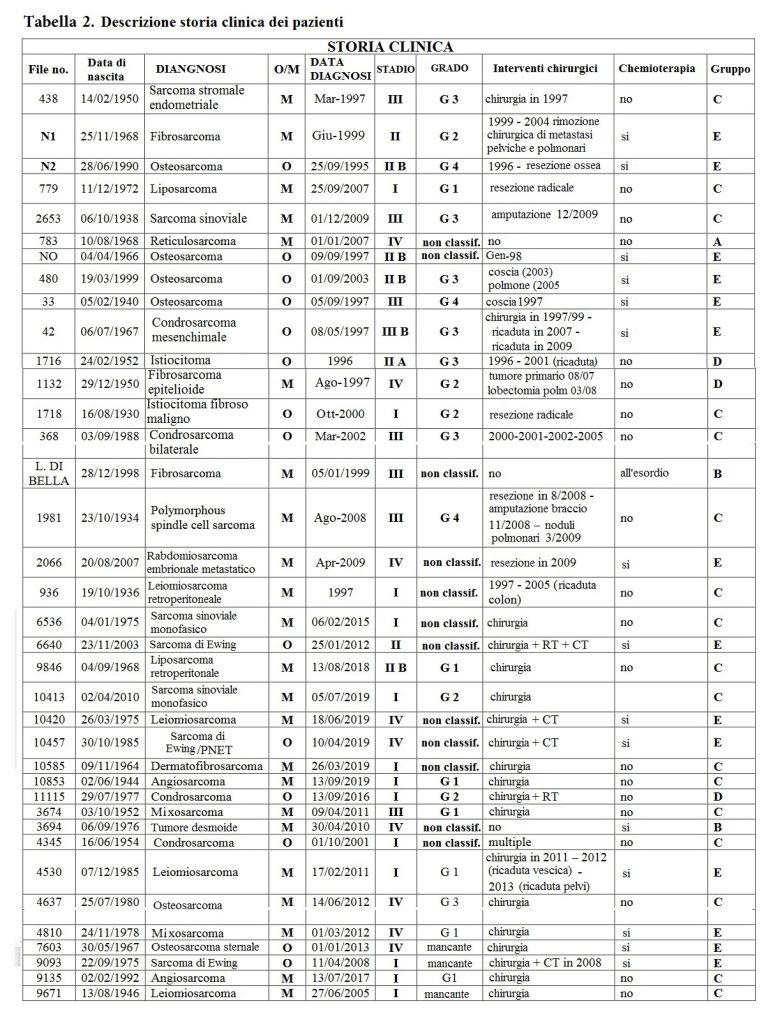
I pazienti con sarcoma trattati con MDB e valutabili per questo studio hanno tutti una storia medica di diagnosi, stadio e grado del tumore, insieme a trattamenti eseguiti prima del trattamento con MDB. (Tab. 2)
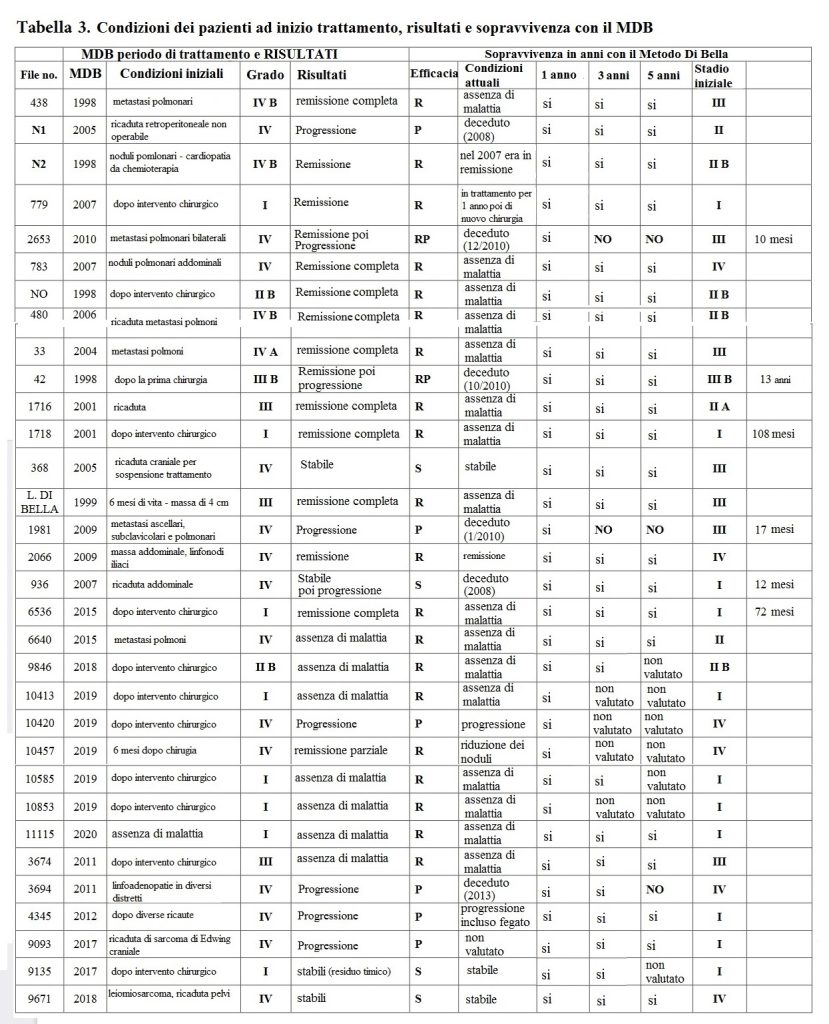
Il diagramma riassuntivo di seguito riassume le condizioni del paziente quando vede per la prima volta il medico che prescrive il MDB, lo stadio e il risultato del trattamento del MDB nel paziente. Da questi dati si evince l’aumento della sopravvivenza (quantificata in anni) rispetto alle percentuali pubblicate nelle linee guida AIOM. (Tab. 3)
DISCUSSIONE
L’eziologia dei sarcomi rimane in gran parte sconosciuta; sono sporadici, idiopatici e correlati a difetti genetici e fattori ambientali. [6,5] I difetti genetici che portano allo sviluppo del sarcoma si dividono in difetti cariotipici semplici e difetti cariotipici complessi. [7] I difetti cariotipici semplici consistono in traslocazioni cromosomiche specifiche della malattia che portano a una funzione genica (e proteica) anormale, che facilita lo sviluppo del sarcoma. I sarcomi associati a semplici difetti del cariotipo includono il sarcoma di Ewing, il rabdomiosarcoma alveolare e il sarcoma sinoviale. Al contrario, complessi difetti cariotipici, come complessi riarrangiamenti cromosomici, intervengono sui geni del ciclo cellulare causando instabilità genetica. I sarcomi generati in questo modo tendono a manifestarsi nei pazienti più anziani e hanno un’alta frequenza di mutazioni nelle vie di segnalazione di p53 e retinoblastoma. [7,8] Leiomiosarcoma, liposarcoma, angiosarcoma e osteosarcoma sono esempi di tali tumori. [7]
Non ci sono prove sull’efficacia di un programma di screening dei sarcomi a causa della diversa modalità in cui si presentano, della loro diffusione onnipresente nelle diverse aree anatomiche e della mancanza di un efficace test diagnostico di massa. [5] Si raccomanda una diagnosi radiologica e patologica, mentre la stadiazione avviene attraverso l’esame citologico, la biopsia con ago tagliente, la biopsia incisionale o la biopsia escissionale. La classificazione per stadio consente una valutazione prognostica. [5]
La sopravvivenza a 5 anni per lo stadio I è di circa il 90%, lo stadio II del 70%, lo stadio III del 50% e lo stadio IV del 10%. [5]
I sarcomi con difetti cariotipici complessi possono essere secondari alla radioterapia. [6,9,10,11,12] Uno studio su pazienti con diagnosi di sarcoma indotto dalla radioterapia ha dimostrato che sono unici nella loro epidemiologia e nelle caratteristiche del tumore. Hanno una prognosi sfavorevole e necessitano di nuove strategie innovative, perché con l’oncologia convenzionale il tasso di sopravvivenza a 5 anni è solo del 32%. [13] Non è un caso che una percentuale significativa di sarcomi ossei aggressivi si manifesti nei bambini e nei giovani in età prepuberale e puberale, perché in questa popolazione il picco positivo di GH e il picco negativo di Melatonina coincidono. Le cellule nelle zone di crescita ossea hanno la più alta espressione del recettore del GH. [14] Un aumento dell’incidenza dei sarcomi è documentato anche nei soggetti più alti della media. [4] Vi è una chiara e crescente conferma del ruolo primario dell’aumento del GH negli osteosarcomi, compreso lo studio statistico di Lisa Mirabello et al., che ha documentato che, rispetto ai soggetti con peso medio alla nascita (2.665-4.045 g), gli individui con peso alla nascita elevato (≥4.046 g) presentava un rischio aumentato di osteosarcoma. Gli individui più alti della media e molto alti avevano un rischio aumentato di osteosarcoma. [4,15]
La significativa diminuzione della melatonina dopo i 3-5 anni di età, con livelli particolarmente bassi nelle fasce di età più colpite da osteosarcomi, in coincidenza con un picco di aumento del GH, è ampiamente documentata. [16, 17, 18]
In vari sarcomi, la percentuale crescente di cellule staminali tumorali rispetto ai diversi fenotipi neoplastici di questi tumori è molto probabilmente la ragione principale per cui questi tumori acquisiscono rapidamente resistenza alla chemio-radioterapia, diventano molto aggressivi e progrediscono rapidamente.
Fenomeni di proliferazione incontrollata e perdita di differenziazione, anche se in misura diversa, sono denominatori comuni a tutti i tumori.
La sintesi proteica e la proliferazione cellulare (normale e neoplastica) sono strettamente dipendenti dall’interazione della Prolattina con il più grande induttore di crescita, l’ormone della crescita (GH – Growth Hormone) [19;20;21;22;23], e dalle molecole mitogeniche, fattori di crescita GH-dipendenti che sono positivamente da essa regolamentati, quali Fattore di crescita epidermico (EGF), Fattore di crescita fibroblastico (FGF), Fattore di crescita degli epatociti (HGF), Fattore di crescita simile all’insulina 1 (IGF1), Fattore di crescita endoteliale vascolare (VEGF), Fattore di crescita derivato dalle piastrine (PDGF) [24,25,26,27,28], così come la crescita gastrointestinale come Peptide intestinale vasoattivo (VIP), Colecistochinina (CCK), Gastrina (G). [29]
I recettori del GH (GHR)e della PRL (PRLR) sono co-espressi sulle membrane cellulari e si dimerizzano, amplificando la trasduzione delle vie di segnalazione proliferative. [30] Numerosi studi indicano come questi ormoni ipofisari svolgano un ruolo cruciale nello sviluppo e nella progressione dei tumori umani. La loro espressione recettoriale è onnipresente [19,31,32,33] e particolarmente elevata nel tessuto canceroso, con una relazione dose-dipendente tra l’espressione del recettore GH-PRL e i processi di induzione e progressione del tumore, rilevata istochimicamente e attraverso tecniche di immunoistochimica, Western Blot, tecniche di ibridazione in situ e qPCR. La documentazione di concentrazioni di GHR molto più elevate nei tessuti tumorali rispetto ai tessuti normali e peritumorali conferma il suo potente ruolo mitogeno. [15,21,20,34,35]
Questa evidenza spiega il motivo per cui il MDB utilizza somatostatina, analoghi e inibitori della prolattina per prevenire la proliferazione e i restanti componenti del Metodo per ottenere una funzione differenziante, immunomodulante e antiossidante. Il MDB supporta e potenzia le reazioni vitali e l’omeostasi antitumorale, aiutandole a contrastare l’insorgenza della neoplasia e la sua progressione. [36] Il MDB persegue questo obiettivo attraverso formulazioni e criteri innovativi per l’utilizzo della MLT (complessata con adenosina e glicina), dei retinoidi solubilizzati in Vitamina E, nonché dei componenti delle Vitamine C, D3 ed matrice extracellulare (ECM). L’inserimento di componenti apolari come il Betacarotene e la Vitamina E tra i fosfolipidi di una membrana cellulare la stabilizza, preservandola dal danno ossidativo e dai radicali liberi. [37,38,39,40,41,42,43,44]
Sarcomi, quindi , rappresentano un ampio gruppo di malattie maligne eterogenee, con un’unica caratteristica comune, ovvero l’origine mesenchimale. L’eterogeneità dei sarcomi si manifesta nella massa tumorale ma anche intratumorale, il che implica l’esistenza di cellule staminali del sarcoma che possono derivare da cellule staminali mesenchimali. Le cellule staminali mesenchimali sono state, infatti, utilizzate per stabilire diversi modelli sperimentali cruciali di sarcoma e per tracciare le rispettive popolazioni di cellule staminali. Le cellule staminali mesenchimali sono eterogenee e possono svilupparsi in modo diverso. La diversa origine delle cellule determina una sostanziale eterogeneità nell’eventuale inizio del sarcoma. I cambiamenti genetici ed epigenetici associati alla sarcomagenesi possono produrre cellule staminali del sarcoma. Nel caso di sarcomi pediatrici caratterizzati da traslocazioni reciproche discrete e cariotipi sostanzialmente stabili, gli oncogeni attivati dalla traslocazione potrebbero essere fattori cruciali che conferiscono staminalità, modificando principalmente il trascrittoma e interferendo con la normale regolazione epigenetica. Gli esempi più studiati di questo processo sono il liposarcoma mixoide/a cellule rotonde, il sarcoma di Ewing e il sarcoma sinoviale. Nei sarcomi adulti, che hanno tipicamente cariotipi complessi e instabili, la staminalità potrebbe essere definita più operativamente, come riflesso dell’effettivo assemblaggio di fattori staminali geneticamente ed epigeneticamente condizionati e/o indotti dal microambiente. I meccanismi molecolari della staminalità potrebbero essere significativamente simili in diversi tipi di sarcoma, come il silenziamento degli oncosoppressori pRb e p53, l’attivazione di Sox-2 o l’inibizione della segnalazione canonica di Wnt/β-catenina. Inoltre, esiste un’omologia con marcatori di cellule staminali di vari carcinomi o leucemie. Comprendere la biologia delle cellule staminali del sarcoma può migliorare la terapia. [45] Coerentemente con questa strategia, senza osservare la tossicità alle dosi somministrate, sono state aumentate le dosi dei componenti attivi della MDB come MLT, ATRA, vitamine D e C, Glucosamina, Somatostatina e analogo dell’octreotide e sono state aggiunte molecole attive sulle cellule staminali, tali come Disulfiram e Acetazolamide, che verranno contestualizzati razionalmente di seguito.
In questo studio sono stati analizzati 37 casi di sarcoma (dell’osso e dei tessuti molli) trattati con il Metodo Di Bella (MDB). Il trattamento ha migliorato significativamente la sopravvivenza e la qualità della vita nei pazienti affetti da sarcoma rispetto ai pazienti con sarcomi aventi caratteristiche immunoistochimiche, istologiche e cliniche simili (statistica oncologica). La multiterapia prevede, per prevenire la proliferazione, la Somatostatina e l’analogo dell’Octreotide, con inibitori della prolattina agonisti dei recettori dopaminergici D2 (D2R), mentre ATRA, Beta-Carotene, Axeroftolo, solubilizzato in vitamina E, oltre alle vitamine D e C, Melatonina idrosolubile, Glucosamina e Condroitina solfato sono stati inclusi per la loro azione differenziante, citostatica, immunomodulante e antimetastatica. L’idrossiurea è stata utilizzata a basse dosi metronomiche per indurre l’apoptosi.
MELATONINA
La melatonina (N-acetil-5-metossitriptamina, MLT) ha proprietà antiossidanti, antietà e immunomodulatorie. Svolge un ruolo significativo nella composizione del sangue, nella dinamica midollare, nella formazione delle piastrine, nella protezione dell’endotelio vascolare, nell’aggregazione piastrinica, nella regolazione dei rapporti leucocitari e della sintesi dell’emoglobina, nella perfusione e negli scambi emato-tessutali. Sono inoltre documentate le notevoli e non tossiche proprietà apoptotiche, oncostatiche, antiangiogeniche, differenzianti e antiproliferative di questo indolo su tutte le malattie neoplastiche, sia solide che liquide. [40,46,47,48,49,50,51,52,53,54,55,56,57,58, 59,60,61,62,63,64,65,66,67,68]
Grazie alla sua notevole versatilità funzionale, la MLT può avere un effetto antitumorale diretto e indiretto in sinergia fattoriale con altre molecole differenzianti / antiproliferative / immunomodulanti del MDB. L’interazione della MLT con le molecole MDB contrasta i molteplici processi che caratterizzano il fenotipo neoplastico, la mutazione, la proliferazione, la progressione e/o la disseminazione. Tutte queste caratteristiche suggeriscono l’uso di questa molecola nelle patologie oncologiche. [69,70,71,72] La MLT svolge anche un ruolo significativo nella perfusione e negli scambi emato-tessutali, prevenendo l’ischemia tissutale, l’acidosi e l’ipossia dell’ambiente neoplastico e la conseguente sovraespressione di geni oncogenici, incluso HIF-1α. L’effetto di espansione anticellulare si ottiene anche attraverso la riduzione delle specie reattive intracellulari dell’ossigeno e l’aumento degli antiossidanti. [46]
Poiché ora ci sono prove della correlazione tra il calo dei livelli di melatonina, l’aumento del GH e dell’incidenza di osteosarcomi giovanili, la melatonina è stata studiata per la sua azione anti-osteosarcoma, come coadiuvante della chemioterapia convenzionale per l’osteosarcoma per migliorare la prognosi della malattia, che nella maggior parte dei casi è infausta. [73] Oltre ai molteplici e sopra menzionati meccanismi d’azione antitumorali della MLT, stanno emergendo alcune delle sue particolari proprietà nell’osteosarcoma. Questo tumore si verifica più frequentemente negli adolescenti, con un picco di incidenza tra 11 e 15 anni. Il declino della MLT a livelli minimi negli stessi gruppi di età, insieme a un aumento del livello di GH (e fattori correlati come IGF1, VEGF, EGF, FGF) e alla successiva crescita ossea, spiega il picco di osteosarcoma in questi gruppi di età. La sede iniziale più frequente dei sarcomi è la metafisi delle ossa lunghe (femore distale e tibia prossimale) le cui cellule hanno la più alta espressione dei recettori del GH e quindi un alto indice proliferativo. La relazione tra l’incidenza dell’osteosarcoma e il tasso di crescita ossea [74] è evidente. Il razionale per l’uso della melatonina e della somatostatina contro i sarcomi è quindi logico e scientificamente documentato.
La melatonina blocca la proliferazione delle cellule dell’osteosarcoma MG-63 riducendo le cicline D1 e B1, CDK4 e CDK1, bloccando il ciclo cellulare nell’interfase, con un aumento delle cellule nella fase G0/G1. Nelle cellule di carcinosarcoma, la somministrazione di MLT ha comportato una riduzione dell’espressione di Bcl-2 e una diminuzione del volume del tumore. [75] Nel sarcoma di Ewing, la melatonina induce la morte cellulare nelle cellule SK-N-MC aumentando l’espressione del recettore Fas e del rispettivo ligando FasL attraverso la via della caspasi 8. L’espressione di Fas/FasL è controllata dall’attivazione del fattore nucleare NF-kB, aumentato dalla melatonina, in relazione allo stato redox intracellulare. [76] Nei leiomiosarcomi, la MLT inibisce la crescita tumorale bloccando l’assorbimento e il metabolismo dell’acido linoleico, che porterebbe alla produzione e al rilascio del mitogeno 13-HODE, ERK1/2, MEK e Akt, nonché alla soppressione della produzione di cAMP nei tumori. [77]
La differenziazione delle cellule staminali mesenchimali è regolata dall’azione di segnali meccanici e molecolari provenienti dall’ambiente extracellulare. La melatonina può anche essere un importante regolatore dell’impegno e della differenziazione dei precursori cellulari. È noto che l’adipogenesi e l’osteogenesi sono reciprocamente correlate nel midollo osseo. Sulle cellule staminali mesenchimali umane, la melatonina inibisce direttamente la differenziazione adipogenica verso il lignaggio adipocitario e promuove contemporaneamente la differenziazione osteogenica sopprimendo l’espressione del recettore γ (PPARγ) attivato dal proliferatore del perossisoma e migliorando il fattore di trascrizione correlato a Runt 2 (RUNX2). La MLT migliora la differenziazione delle cellule staminali mesenchimali umane in osteoblasti attraverso i recettori MT2 e la cascata di segnalazione mitogenica/chinasi regolata dal segnale extracellulare (MEK)/chinasi regolato dal segnale extracellulare (ERK). [18]
La melatonina, con le sue proprietà immunomodulanti, mieloprotettive, differenzianti e antiossidanti, aumenta gli effetti antitumorali della chemioterapia riducendone la tossicità. Attraverso l’effetto radioprotettivo e radiosensibilizzante, migliora la risposta terapeutica alla radioterapia riducendo la radiotossicità e gli insuccessi terapeutici dovuti in gran parte alla refrattarietà delle cellule tumorali mesenchimali del sarcoma alle terapie citolitiche e radioterapiche. Una significativa proprietà terapeutica della melatonina è la differenziazione e la riprogrammazione di cellule staminali mesenchimali, progenitori multipotenti, osteociti, condrociti, miociti e adipociti.
SOLUZIONE DI RETINOIDI IN VITAMINA E
I retinoidi sono una famiglia di molecole che derivano dal metabolismo della vitamina A, o retinolo. [78] La loro funzione è mediata dai rispettivi recettori sulla membrana plasmatica e sulla membrana nucleare che agiscono sulla crescita cellulare, sulla differenziazione, sull’omeostasi dei tessuti e sull’apoptosi attraverso la via della caspasi 9, con un importante e documentato effetto nella prevenzione e nel trattamento dei tumori. [75] I retinoidi sono i più potenti attivatori non ormonali di una crescita esclusivamente ordinata e funzionale finalizzata all’equilibrio biologico ottimale, mentre, allo stesso tempo, con tossicità differenziale, inibiscono la crescita neoplastica senza scopo e disordinata con il loro effetto antiproliferativo e citostatico. Insieme alla Melatonina, i retinoidi sono le uniche molecole biologiche a tossicità differenziale, con effetto citostatico e apoptotico sulle sole cellule tumorali e non su quelle sane nelle quali, al contrario, sono aumentate sopravvivenza e funzionalità. I retinoidi possono preservare e aumentare la vitalità e l’efficienza delle cellule normali e allo stesso tempo inibire quelle neoplastiche, che hanno la tendenza a mutare. I retinoidi intervengono in due aspetti critici della biologia neoplastica: la rapida proliferazione e le conseguenti mutazioni, denominatori comuni di tutti i tipi di cancro. Svolgono un ruolo cruciale sia nella prevenzione che nella terapia del cancro, limitando le conseguenze indotte dal cancro e dalle terapie antitumorali convenzionali. [23,79,80,81,82,83,84,85,86,87,88,89, 90,91,92,93,94,95]
FUNZIONI DEI COMPONENTI DELLA SOLUZIONE RETINOIDE
1) BETA-CAROTENE
– Protettivo sulle membrane cellulari [36];
– Direttamente antiproliferativo (indipendentemente dalla conversione in ATRA) sulle cellule tumorali, sopprimendone la mobilità (misurata mediante il dosaggio del tetrazolio “MTT”), la sintesi del DNA (controllata attraverso l’assorbimento di 3H-timidina) e la proliferazione (misurata dalla conta cellulare).
2) ACIDO RETINOICO
– Agisce inducendo la ridifferenziazione nei blasti e nelle cellule tumorali [96];
– sopprime la trascrizione dei geni dei fattori oncogeni e promuove l’effetto antiproliferativo [97];
– Ha azione anti-angiogenica [98];
– Diminuisce il potenziale di proliferazione neoplastica e svolge un ruolo importante nella differenziazione cellulare, nell’apoptosi e nell’adesione [99,100];
– rende le cellule neoplastiche particolarmente sensibili agli agenti chemioterapici, inducendo anche un aumento della comunicazione intercellulare negli spazi di giunzione [101];
– Contrasta l’effetto epatotossico della chemioterapia. [102]
3) VITAMINA A
Provoca l’apoptosi delle cellule neoplastiche attraverso l’attivazione di enzimi della cellula proteolitica, le caspasi e la degradazione del fattore di trascrizione generale Sp-1. [103,104]
4) VITAMINA E
Tra i tocoferoli, l’alfa-tocoferolo ha la più alta attività biologica. Comunemente denominata vitamina E, ha un’elevata attività antiossidante e antiradicali liberi. In quanto costituente dei sistemi enzimatici, la vitamina E influisce direttamente su un passaggio chiave dello scambio energetico e della vita stessa, il trasporto di elettroni nella catena respiratoria;
– Inibisce la crescita di varie linee cellulari tumorali [105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116,117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130];
– Potenzia l’azione antitumorale di vari farmaci chemioterapici come Adriamicina, cisplatino e tamoxifene [116, 120];
– Protegge le cellule del midollo osseo dagli effetti letali della doxorubicina [107]
– potenzia l’effetto antitumorale degli agenti chemioterapici, proteggendo le cellule sane dagli effetti tossici [117];
– Ha attività anti-angiogenica. [37,109,112,113,123]
È stato osservato che, nelle persone con sarcoma, il numero di cellule granulocitarie del tipo cellule soppressorie mieloidi (MDSC) è maggiore che in condizioni sane, con conseguente riduzione dell’efficienza dei linfociti T. L’acido retinoico ha la capacità di regolare la differenziazione delle cellule MDSC e, ha potere antitumorale e combatte meglio l’azione immunosoppressiva associata alle cellule MDSC nel sarcoma. [131]
Quando le cellule dell’osteosarcoma umano vengono trattate con ATRA, è stata osservata una maggiore espressione dei recettori della vitamina D3; inoltre, il trattamento sinergico con ATRA e calcitriolo è associato ad un aumento dell’efficacia dell’effetto antiproliferativo su queste linee cellulari. [132]
L’acido retinoico agisce durante le fasi iniziali dell’osteosarcoma associato ai macrofagi, inibendo l’attività delle cellule neoplastiche. [133] Può stimolare la differenziazione cellulare nelle cellule dell’osteosarcoma e quindi agire negativamente sulla proliferazione cellulare e indurre l’apoptosi; queste proprietà sono state osservate non solo nei casi di osteosarcoma, ma anche nel sarcoma di Kaposi, nel neuroblastoma e nel cancro al seno. [134] Studi sulle linee cellulari di sarcoma di Kaposi trattate con acido retinoico hanno dimostrato che agisce regolando negativamente la crescita cellulare; è stata anche osservata una maggiore adesione cellulare[135].
Il trattamento con acido retinoico, che agisce attraverso l’aumento del rilascio di enzimi lisosomiali, può essere una terapia potenzialmente efficace contro il condrosarcoma. [136] Nel dermatofibrosarcoma protuberans, il recettore dell’acido retinoico è implicato nella ridotta aggressività della crescita neoplastica. [137]
VITAMINA E
La vitamina E (Tocoferolo) è liposolubile e presente in otto isoforme, note per la loro azione contro la formazione di specie reattive dell’ossigeno e dell’azoto nei tessuti neoplastici a seguito di alterazioni dei sistemi ossidativi. La vitamina E svolge anche importanti funzioni inibitorie nell’angiogenesi, nella via di segnalazione NF-kB e sull’enzima HMG CoA reduttasi. [138]
In diversi tumori, compreso il sarcoma, è stata osservata un’involuzione timica, che porta alla morte dei timociti e quindi a una diminuzione della produzione di cellule T, con conseguente diminuzione dell’efficienza del sistema immunitario. [139]
In uno studio preclinico su topi affetti da fibrosarcoma, il meccanismo d’azione della vitamina E è stato valutato in associazione con la ciclofosfamide, un agente alchilante utilizzato in varie terapie antitumorali, sia da solo che in combinazione con altri farmaci citotossici. Tuttavia, può causare iperlipidemia nei pazienti e quindi è stato somministrato in combinazione con α-tocoferolo che riduce l’iperlipidemia. I risultati hanno mostrato che il metabolismo lipidico è tornato a livelli normali nei topi trattati e l’iperlipidemia è stata significativamente ridotta rispetto ai valori osservati nei gruppi di controllo non trattati. [140]
La vitamina E riduce anche i danni da stress ossidativo, regola l’omeostasi osteocartilaginea e promuove l’apoptosi tumorale sia in vitro che in vivo. [141]
VITAMINA D3
La vitamina D3 viene sintetizzata nella pelle, a partire dalla vitamina D, in seguito all’esposizione ai raggi ultravioletti. Può essere introdotta con la dieta; basse concentrazioni di vitamina D3 sono associate ad una maggiore sensibilità alle infezioni e ai tumori. La forma biologica attiva della vitamina D3, ovvero il calcitriolo, e i suoi analoghi svolgono importanti funzioni antitumorali mediate dal recettore nucleare, VDR. [142]
Nel sarcoma di Kaposi associato al virus dell’Herpes, è stato osservato che il calcitriolo, sia in vitro che in vivo, regola negativamente la crescita delle cellule endoteliali. Il calcitriolo induce la morte cellulare attraverso una maggiore espressione di VDR. Riduce anche il processo di cancerogenesi, e agisce nel processo angiogenico. [143] Il trattamento del sarcoma di Kaposi con calcitriolo si traduce anche in una diminuzione della produzione di interleuchina 6 e 8, due importanti fattori di crescita in questo tumore. [144]
Uno studio condotto su sette linee cellulari di osteosarcoma umano ha dimostrato che la terapia con ATRA e calcitriolo inibisce la proliferazione cellulare e aumenta la sensibilità agli induttori di differenziazione con maggiore efficacia rispetto a quando le molecole vengono utilizzate da sole. Inoltre, l’ATRA aumenta indirettamente l’espressione del recettore della vitamina D3. [132]
Analizzando in vitro la linea cellulare di osteosarcoma umano MG-63, è stata osservata una diminuzione della crescita cellulare, della densità di saturazione e dell’assorbimento di [3H]-timidina in seguito alla somministrazione di calcitriolo; inoltre, è stato osservato un aumento dell’adesione cellulare nelle cellule trattate a seguito di un aumento della fibronectina. [145]
I metaboliti della vitamina D3 agiscono anche sulla differenziazione cellulare nelle cellule di osteosarcoma alle stesse dosi alle quali inibiscono la crescita, oltre a indurre la sintesi di osteocalcina. [146] L’effetto antiproliferativo del calcitriolo è stato studiato su diverse linee cellulari di sarcoma dei tessuti molli, inclusi rabdomiosarcoma, fibrosarcoma, liposarcoma, leiomiosarcoma e sarcoma sinoviale, in relazione all’espressione di VDR. La crescita cellulare dopo il trattamento con calcitriolo è inibita in modo più efficace nelle cellule con una maggiore quantità di VDR e viceversa. Questo studio ha mostrato la correlazione tra l’espressione di VDR e l’effetto del calcitriolo sui sarcomi dei tessuti molli. [147]
FUNZIONI DELLA VITAMINA D3
– attività pro-differenziazione, ottenuta non solo attraverso l’interazione con il recettore, ma anche attraverso un meccanismo extra-recettoriale mediato dalla membrana [148];
– Inibizione dell’angiogenesi, sviluppo e crescita indotta dal VEGF (vascular endothelial growth factor), in maniera dose-dipendente; inibizione della formazione di reti cellulari endoteliali allungate, favorendo l’apoptosi [149];
– La vitamina D3 attiva uno specifico recettore nucleare, inibendo la proliferazione, favorendo la differenziazione di vari tipi di cellule tumorali e l’adesione delle cellule che migrano dalla membrana basale, nelle cellule tumorali prostatiche in vivo [150];
– Induzione dell’espressione di mRNA per la proteina BRCA1 (proteina regolatrice del ciclo cellulare). La sensibilità agli effetti antiproliferativi della Vitamina D3 è intimamente legata alla capacità di modulare la proteina BRCA1 mediante l’attivazione trascrizionale dei fattori indotti dal recettore VDR [151];
– L’attivazione di VDR, oltre all’effetto antiproliferativo, aumenta l’espressione di proteine leganti il fattore di crescita insulino-simile [152];
– Induce la maturazione fenotipica delle cellule tumorali in cellule funzionalmente mature, cellule differenziate, fisiologicamente normali, inibendo contemporaneamente la proliferazione cellulare neoplastica potenziando l’effetto antiproliferativo dell’acido trans-retinoico[153];
– Inibisce l’invasione della matrice extracellulare e le metastasi bloccando la degradazione delle barriere della matrice extracellulare (ECM) da parte delle cellule tumorali attraverso collagenolisi [154];
– esercita, anche attraverso meccanismi non recettoriali, una potente azione antiproliferativa e pro-differenziante [155];
– Sopprime la proliferazione e la migrazione nelle linee cellulari di glioma che esprimono il recettore umano della vitamina D. [158]
VITAMINA C
L’acido ascorbico, o vitamina C, ha una grande attività riducente, reagendo direttamente con singoletti di ossigeno, idrossidi e radicali superossido [159]; biologicamente, agisce come un vettore di idrogeno nel metabolismo intermedio, compresi i processi di respirazione cellulare. Per il suo ruolo chiave, è stato incluso nella terapia antitumorale. [160,161,162,163] La capacità antiossidante e il ruolo naturale nell’immunità dell’acido ascorbico sono molto rilevanti, oltre alla sua notevole attività biologica sul trofismo cellulare e sulle strutture di supporto. [164,165] Esso è facile intuire che la vitamina C, unitamente alla melatonina, concorre a regolare questi scambi, portando ad un’ottimale funzione dell’epitelio in termini di resistenza e permeabilità al transito delle cellule tumorali, e quindi di metastasi.
Le funzioni della vitamina C nel MDB sono diverse. Tra questi, i più rilevanti sono:
– prevenire il danno cellulare indotto dalle molecole ossidanti, compresi i radicali liberi [166];
– può avere un ruolo preventivo e terapeutico nel cancro [167];
– può inibire gli effetti cancerogeni di molecole mutagene [168,169];
– può preservare l’integrità del tessuto connettivo in termini di funzione antiblastica [167];
– può esercitare attività angiostatica sulla proliferazione delle cellule endoteliali [170];
– può esercitare un’attività antineoplastica attraverso vari meccanismi d’azione. [33,171]
– può avere un’attività antimetastatica attraverso la sintesi del collagene [172,173], l’inibizione della ialuronidasi [174] e diminuendo la permeabilità delle cellule endoteliali alle popolazioni di cellule neoplastiche [175]
– Può ridurre la tossicità di agenti chemioterapici come l’Adriamicina [176,177];
– Riduce il rischio di gliomi [178];
– L’uso della Vitamina C per via endovenosa è un sicuro intervento di supporto, riducendo l’infiammazione e i sintomi legati alla carenza di antiossidanti e gli effetti collaterali dei trattamenti antitumorali standard [179,180];
– Può indurre la degradazione del fattore inducibile ipossico HIF-1, essenziale per la sopravvivenza delle cellule tumorali in condizioni ipossiche. [165]
La vitamina C, o acido ascorbico, è un antiossidante solubile in acqua che reagisce con il superossido, i radicali idrossilici e i singoletti dell’ossigeno; in studi di laboratorio, è stato osservato che l’acido ascorbico protegge i lipidi plasmatici e le lipoproteine a bassa densità (LDL) dal danno perossidativo e dalla degenerazione associati all’invecchiamento e a malattie come il cancro. È molto importante per la sintesi del glicosaminoglicano, da parte dei proteoglicani, e per la sintesi del collagene.
L’acido ascorbico agisce su vari tipi di cancro nell’uomo; cattura i radicali liberi e le specie reattive dell’ossigeno e riduce i nitriti, prevenendo effetti ossidativi e danni al DNA e alle membrane cellulari causati dai radicali liberi associati al tumore.
Gli studi hanno dimostrato che, insieme alla vitamina C, molti altri nutrienti alimentari, come la vitamina E, i carotenoidi e l’acido folico, partecipano ai processi protettivi. [159]
La vitamina C, nei topi trattati con metilcolantrene (MCA), ha ridotto significativamente l’insorgenza del sarcoma rispetto ai gruppi di controllo, dimostrando l’effetto profilattico di questo componente [181]; inoltre, a concentrazioni sovrafisiologiche, inibisce la proliferazione cellulare e favorisce la differenziazione degli osteoblasti. [182]
Sono stati osservati casi di regressione dei sarcomi a seguito di trattamento continuo con alte dosi di vitamina C [183], così come l’inibizione del processo di angiogenesi. [184] A dosi fisiologiche, l’acido ascorbico regola negativamente la migrazione delle cellule di carcinosarcoma, inibendo così le metastasi tumorali. [185]
ANALOGHI DELLA SOMATOSTATINA E DELLA SOMATOSTATINA
La somatostatina è un peptide di 14 aminoacidi, che ha proprietà antitumorali documentate, evidenti e generalizzate, come già affermato nella pubblicazione del premio Nobel Schally, nel 1998 “Un’ impressionante attività antineoplastica degli analoghi della somatostatina è stata dimostrata in molti modelli tumorali”. Il professor Di Bella aveva già pubblicato nel 1979 [186] uno studio sugli effetti antitumorali della somatostatina in sinergia con altri componenti del suo metodo, come una soluzione di retinoidi in vitamina E, inibitori della prolattina e melatonina. Nel 1981 [187] ha presentato una relazione su più di mille casi di neoplasie trattate favorevolmente con la somatostatina.
Indipendentemente dalla presenza dei recettori della somatostatina (SSTR) nelle cellule tumorali, i meccanismi d’azione della somatostatina sono diretti attraverso l’inibizione della crescita cellulare, inducendo l’apoptosi e prevenendo le metastasi; indiretti, sopprimendo la produzione di fattori di crescita e di angiogenesi. [188]
L’uso di somatostatina e analoghi, regolando negativamente GH e fattori di crescita GH-dipendenti, è un’indicazione razionale per il suo utilizzo in qualsiasi tumore. [15, 21, 62, 90, 186, 189, 190, 191, 192, 193] È evidente che l’asse PRL/GH/GF (prolattina / ormone della crescita / fattori di crescita) ha un’influenza decisiva sullo sviluppo neoplastico, da qui il razionale per l’uso sinergico contro il cancro di antiprolattinici come gli agonisti dei recettori dopaminergici D2R con antagonisti biologici del GH, come la Somatostatina e analoghi, che estendono la loro regolazione negativa a fattori di crescita altamente mitogeni GH-correlati, come fattore di crescita simile all’insulina 1-2 (IGF1-2)[189,194], Fattore di crescita epidermico (EGF) [195,196], Fattore di crescita fibroblastico (FGF) [197], Fattore di crescita endoteliale vascolare (VEGF) [170,198,199], Fattore di crescita derivato dalle piastrine (PDGF) [200] e le relative vie di segnalazione, con conseguenti effetti anti-proliferativi, pro-apoptotici, differenzianti e anti-angiogenici. [ 196] Questa visione sta lentamente emergendo attraverso ricerche sempre più basilari, anche se ancora raramente applicate all’uomo. In molti tumori, non solo in quelli neuroendocrini, è stata documentata l’espressione di un recettore della somatostatina. [21, 75, 196, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226] Sebbene assenti nelle membrane cellulari di alcuni tumori, i recettori SST sono quasi sempre espressi nei vasi peritumorali.
I recettori dei fattori di crescita (GFR) rispondono mitogenicamente all’IGF e l’effetto soppressivo della somatostatina e degli analoghi sui livelli sierici di IGF1 è diretto (inibendo il gene IGF) e indiretto (sopprimendo il GH e quindi la sua induzione di IGF1 nel fegato). L’effetto antiproliferativo della somatostatina e dei suoi analoghi nei sarcomi, come in altri tumori maligni, è quindi ottenuto anche attraverso meccanismi che coinvolgono la soppressione del sistema IGF. [227] La regressione e la sopravvivenza a lungo termine con la somatostatina di un paziente con gliosarcoma primario, una rara neoplasia con prognosi negativa a breve termine, conferma l’efficacia e l’indicazione della somatostatina. [19,20,21,22,23,228]
Molecole GH mitogeniche come EGF, FGF (i cui recettori sono co-espressi sulle membrane cellulari), IGF, VEGF [24,25,26,27,28] e fattori di crescita prodotti dal sistema gastrointestinale (VIP, CCK, G) [ 29], sono tutti regolati negativamente da Somatostatina e Octreotide. Questa evidenza convalida la razionalità dell’uso, in oncoterapia, di somatostatina/octreotide che agiscono indipendentemente dalla presenza di SSTR nelle cellule neoplastiche, data l’evidenza su di esse nei vasi peritumorali e i suddetti meccanismi antitumorali indiretti.
I recettori della somatostatina sono stati identificati sulle cellule dell’osso e sui tumori vascolari / perivascolari, indicando che queste neoplasie sono l’obiettivo della terapia con somatostatina. [229] Negli studi preclinici, è stato dimostrato che la somatostatina inibisce la crescita delle cellule del sarcoma di Kaposi con i recettori SST. In un modello in vivo, la somatostatina inibisce efficacemente l’angiogenesi, mentre in vitro agisce sia sulle cellule endoteliali che sui monociti, inibendo la crescita e l’invasione. La sua somministrazione in queste neoplasie, dovrebbe essere mantenuta nel tempo in quanto la somatostatina agisce principalmente come angiostatico. [198]
Anche la soppressione indotta dalla somatostatina e dai suoi analoghi sui livelli di corticotropina è importante, perché le cellule del condrosarcoma sono sensibili a queste molecole.
Negli studi sugli xenotrapianti di cancro umano e roditore, l’analogo della somatostatina TT-232 porta a una diminuzione della crescita del tumore, sebbene ciò dipenda dalla sensibilità del tumore alla somatostatina, con un rallentamento della crescita dell’osteosarcoma S-180 del 67-100%. [230] L’octreotide è un analogo della somatostatina con un’emivita più lunga rispetto al peptide naturale. In vitro e in vivo inibisce la crescita delle cellule che esprimono i recettori ad alta affinità per la somatostatina, ma agisce anche indirettamente riducendo la concentrazione di GH e IGF-1. [231] È stato anche osservato che l’octreotide ha un forte effetto di soppressione del VEGF, con conseguente effetto anti-angiogenico. [232]
In uno studio sui ratti, a seguito di una parziale rimozione del fegato, è stato studiato l’effetto dell’octreotide sulla crescita tumorale nelle cellule epatiche rigeneranti ed è stato osservato che, a seguito della somministrazione del farmaco, la proliferazione delle cellule del fibrosarcoma e dell’adenocarcinoma del colon era inibita. [233]
SOLFATO DI CONDROITINA
I proteoglicani del condroitin solfato (CS) partecipano alla modulazione di varie funzioni cellulari, inclusa l’adesione e la migrazione cellulare. Il ruolo della catena del condroitin solfato nell’adesione, nella chemiotassi e nella migrazione è stato studiato nelle cellule di fibrosarcoma. La scissione delle catene di CS associate alle cellule e l’inibizione specifica della produzione endogena di CS hanno gravemente compromesso queste funzioni cellulari del fibrosarcoma. Questo risultato mostra che la riduzione dei proteoglicani del condroitin solfato, ad es. attraverso la scissione delle catene CS, inibisce la motilità cellulare, la migrazione e l’adesione nel fibrosarcoma. [234]
Nell’anabolismo osseo mediato da estrogeni, il condroitin solfato-E svolge un ruolo essenziale aumentando la differenziazione e la maturazione degli osteoblasti. Il controllo dell’espressione di condroitin solfato-E nel metabolismo osseo ha quindi un importante potenziale terapeutico per migliorare la perdita di mineralizzazione ossea. [235]
Nei pazienti guariti dall’osteosarcoma, il rischio di sviluppare l’osteoporosi è maggiore, in particolare se vi sono tre fattori di rischio aggiuntivi: essere di sesso maschile, avere una diagnosi di osteosarcoma in giovane età e avere una bassa massa magra. [236] Altri elementi che possono determinare l’insorgenza di osteoporosi a seguito di cancro sono la chemioterapia, la radioterapia e lo scompenso ormonale, che causano una perdita di densità minerale ossea. Inoltre, i pazienti con osteosarcoma possono avere una ridotta attività fisica durante la terapia o dopo intervento chirurgico e ciò si traduce in una diminuzione della massa muscolare, della vitamina D e della densità minerale ossea. [237]
L’osteoporosi associata al diabete è una malattia ossea, che può compromettere la microstruttura ossea, ridurre la resistenza e aumentare la fragilità ossea e il rischio di fratture. Questo disturbo è associato allo stress ossidativo (che provoca una diminuzione della proliferazione e differenziazione degli osteoblasti) e al processo infiammatorio: nelle persone con diabete il livello di citochine proinfiammatorie è notevolmente più alto che nelle persone sane, con conseguente aumento dello stress ossidativo, la proliferazione degli osteoclasti e l’assorbimento della matrice ossea, causando l’osteoporosi. Inoltre, nei topi con diabete di tipo 1 è stata osservata un’elevata espressione di marcatori biochimici di formazione e riassorbimento osseo, indicando che il turnover dell’elemento osseo è molto maggiore nei casi di diabete. Lo studio della terapia con condroitin solfato nei topi con diabete di tipo 1 ha avuto effetti positivi nel trattamento dell’osteoporosi, portando alla riduzione delle citochine e dell’infiammazione, all’inibizione dello stress ossidativo e del metabolismo osseo, migliorando al contempo la riparazione delle microstrutture ossee. Anche questa terapia è molto sicura, con effetti avversi limitati a disturbi gastrointestinali modesti e transitori come nausea e vomito. [238]
SOLFATO DI GLUCOSAMINA
Le proprietà antitumorali della glucosamina sono documentate da evidenze scientifiche che hanno identificato il meccanismo d’azione antitumorale nell’inibizione delle cellule staminali tumorali (CSC), che sono la sottopopolazione di cellule tumorali deputate al mantenimento del tumore e alla ricaduta, a causa della loro elevatissima capacità di resistere a vari trattamenti antitumorali. [239,240] La glucosamina induce la morte cellulare autofagica attraverso la stimolazione da stress del reticolo endoplasmatico (ER) nelle cellule di glioma umano. Il trattamento con glucosamina ha ridotto la vitalità cellulare aumentando la morte cellulare autofagica delle cellule di glioma. Queste informazioni forniscono nuove informazioni sulle potenziali proprietà antitumorali della glucosamina. [241, 242]
La glucosamina può anche essere un candidato promettente per la prevenzione e/o il trattamento di alcune altre malattie grazie alle sue attività antiossidanti e antinfiammatorie. La maggior parte della sua funzione viene esercitata attraverso la modulazione delle risposte infiammatorie. [243]
Pohlig F. ha condotto uno studio in cui è stato riscontrato che il solfato di glucosamina ha un pronunciato effetto soppressivo nelle linee cellulari di osteosarcoma in vitro. [245,246,247]
Di seguito è riportata una più ampia rassegna della letteratura sulle proprietà differenzianti, citostatiche, immunomodulatorie e omeostatiche di retinoidi, vitamine E, C, D, proteoglicani:
– Di Bella G et al., 2015 [75]
– Di Bella G., 2010 – “Il Metodo Di Bella” Mattioli ED., 2005 [40]
– “La scelta antitumore” Macro-Uno Edizioni, 2019. [47]
BROMOCRIPTINA e CABERGOLINA
La bromocriptina e la cabergolina sono due alcaloidi derivati dal fungo della segale cornuta; sono utilizzati nella terapia preventiva e antitumorale perché sopprimono la sintesi della prolattina, riducono la crescita cellulare e le dimensioni del tumore e inibiscono l’angiogenesi. Numerosi studi hanno dimostrato l’efficacia delle terapie antitumorali con la bromocriptina, suggerendo che la somministrazione di dosi elevate porta ad una riduzione del cancro [248] e svolge un ruolo importante anche nella chemioterapia e nel fenomeno della multiresistenza, in cui le cellule tumorali sviluppano resistenza a diversi farmaci ad azione citotossica. Gli studi hanno dimostrato che può convertire la resistenza farmacologica di un tumore in una condizione normale, ripristinando l’effetto antitumorale di farmaci come la doxorubicina. [249] La cabergolina ha anche un effetto antitumorale sopprimendo i fattori di crescita che promuovono la crescita e l’espansione del tumore. [250]
In un caso clinico di angiosarcoma, l’elevata concentrazione di prolattina, insieme a IL-6 e osteocalcina, era associata a una rapida progressione del tumore. [251]
I tumori la cui crescita è sensibile alla concentrazione di prolattina includono anche il Swarm condrosarcoma. [252]
Questi due componenti sono quindi importanti in quanto portano ad una diminuzione dei livelli di prolattina, che è coinvolta nello sviluppo e nella sensibilità di alcune cellule tumorali. Agiscono attraverso due diversi meccanismi e due vie di segnalazione diverse: la bromocriptina stimola l’apoptosi, mentre la cabergolina induce l’autofagia. [253]
ACIDO URSODOSSICOLICO
L’acido ursodesossicolico è un acido biliare secondario particolarmente importante nel mantenimento dell’integrità della barriera intestinale e nel metabolismo dei lipidi. Aumenta la proporzione di acidi biliari idrofili non tossici e diminuisce gli acidi biliari idrofobici endogeni; aumenta inoltre l’escrezione epatocellulare degli acidi biliari, ha azione citoprotettiva, immunomodulante e inibisce l’apoptosi. [254] È indicato per contrastare l’effetto colagogo e di inibizione coleretica della somatostatina e dell’octreotide.
BUTIRRATO DI SODIO
L’uso del Butirrato di Sodio nei pazienti con sarcoma è contestualizzato epigeneticamente nel rilassamento della cromatina. Secondo lo studio condotto da Singh, il butirrato blocca la generazione di cellule dendritiche dalle cellule staminali del midollo osseo, senza influenzare la generazione dei granulociti. [255]
Questo acido grasso è prodotto nel lume del colon dalla fermentazione batterica della fibra alimentare e il suo trasportatore cellulare, indicato con la sigla SLC5A8, media l’ingresso basato sulla concentrazione di butirrato nella cellula. Di conseguenza, la funzione di trasporto di SLC5A8 ha la capacità di influenzare la funzionalità del sodio butirrato ed è gene oncosoppressore candidato che viene silenziato nel cancro del colon, nel cancro gastrico e possibilmente in altri tumori nell’uomo. [256, 257]
Il sodio butirrato è noto per indurre l’apoptosi in una varietà di tumori. Il butirrato, fattore essenziale per i colonociti e regolatore nello sviluppo del cancro del colon, è parzialmente assorbito dall’intestino. Influenza la proliferazione e la differenziazione di diversi tipi cellulari, inclusi gli osteoblasti. Il butirrato di sodio ha effetti anti-proliferativi, pro-differenzianti e immunomodulatori nelle cellule dell’osteosarcoma. [258]
DISULFIRAM (INIBITORE DELL’ALDEIDE DEIDROGENASI)
Le aldeide deidrogenasi (ALDH) sono una famiglia di enzimi che catalizzano l’ossidazione delle aldeidi formando acidi carbossilici. Questi enzimi sono importanti nell’omeostasi cellulare durante lo stress ossidativo per l’eliminazione dei sottoprodotti tossici dell’aldeide da vari processi cellulari. Nell’osteosarcoma, l’aldeide deidrogenasi 1A1 è stata descritta come un marcatore delle cellule staminali del cancro. È stato riscontrato che la sua attività è correlata al potenziale metastatico e al fenotipo metastatico. [259] Disulfiram è un inibitore dell’ALDH, prodotto per scopi clinici nel trattamento dell’alcolismo; recentemente è stato anche considerato un farmaco che può essere utilizzato per sopprimere le cellule staminali del sarcoma.
Le cellule tumorali del sarcoma si diffondono per invasione locale e metastasi a distanza, che dipendono dalla matrice extracellulare. L’espressione delle metalloproteinasi della matrice (MMP) è stata implicata nell’invasione e nelle metastasi delle cellule tumorali. Cho HJ ha condotto uno studio sugli effetti del disulfiram sulla soppressione dell’invasione tumorale, nonché sui suoi effetti sull’attività di MMP-2 e MMP-9 nelle cellule di osteosarcoma umano (U2OS). Gli effetti antitumorali del disulfiram sono stati dimostrati in un test di invasione (che utilizza cellule U2OS) dove ha inibito l’espressione delle metalloproteinasi MMP-2 e MMP-9 e ha regolato l’invasione delle cellule di osteosarcoma umano, rendendolo un farmaco clinicamente utilizzabile per l’inibizione dell’invasione del cancro. [260]
INIBITORI DELLA CARBOANIDRASI
Le anidrasi carboniche (CAH), metalloproteine dello zinco, sono enzimi che possono avere una rilevanza clinica nella terapia del cancro, perché la loro isoforma specifica sulla superficie cellulare, indicata con la sigla CA IX, è quasi esclusivamente associata ai tumori ed è coinvolta nella carcinogenesi. La sua inibizione competitiva mediata dall’acetazolamide (AAZ) fa parte dello sviluppo di nuove terapie contro il cancro. Sulla base di queste prove, abbiamo aggiunto AAZ al MDB.
L’ipossia è associata a progressione maligna e scarso esito in diversi tumori umani, compreso il sarcoma dei tessuti molli. Lo studio condotto da Måseide ha suggerito che l’anidrasi carbonica IX (CA IX) è un potenziale marcatore intrinseco di ipossia e un predittore di prognosi sfavorevole nei pazienti con sarcoma dei tessuti molli di grandi dimensioni, di alto grado e profondo. [261] Il CA IX è spesso sovraespresso nell’osteosarcoma (OS) umano ma non nei tessuti normali e i suoi livelli di espressione sono correlati alla prognosi. Nello studio condotto da Perut, è stato studiato il potenziale terapeutico di sulfamidi come inibitori di CA IX di nuova sintesi nell’osteosarcoma, concludendo che l’uso di inibitori di CA IX ha ridotto la crescita del tumore, portando a una necrosi significativa. [262]
CONCLUSIONI
I pazienti trattati con MDB, pur manifestando una tossicità rara e temporanea di modesta entità, hanno mostrato un netto miglioramento in termini di sopravvivenza, risposta obiettiva e qualità della vita rispetto ai pazienti con sarcomi negli stessi stadi, con le stesse caratteristiche istochimiche, trattati con protocolli oncologici convenzionali.
I rari casi in cui il MDB è stato applicato come terapia di prima linea, sia neoadiuvante che adiuvante, hanno avuto le migliori risposte.
Nella progressione dei sarcomi, come nella maggior parte dei tumori, la percentuale di cellule staminali tumorali, rispetto ad altre componenti della popolazione neoplastica, aumenta fino ad essere quasi totale ed è associata a chemio-radio-resistenza e rapida progressione. Per questo motivo abbiamo gradualmente aumentato le dosi di molecole che nella letteratura scientifica sono documentate per regolare negativamente le cellule staminali tumorali (CSCs), come Melatonina, ATRA, Glucosamina, che migliorano la differenziazione e la riprogrammazione delle cellule staminali tumorali regolando negativamente proliferazione, invasività e resistenza. Questo obiettivo è stato raggiunto anche modificando i criteri e le modalità di somministrazione di farmaci alchilanti, come l’idrossiurea. A differenza dei protocolli oncologici, la loro somministrazione metronomica nel MDB ha consentito un migliore controllo della proliferazione e dell’invasività delle cellule tumorali in assenza di mielotossicità, grazie alle proprietà mieloprotettive di 100 mg al giorno di melatonina idrosolubile e circa 25 ml di soluzione retinoide in vitamina E, suddivisa in 3 somministrazioni giornaliere. [46,48,263] L’effetto antiproliferativo e antiangiogenico è stato aumentato dalla combinazione regolare di 4 mg di somatostatina a 14 aminoacidi somministrati con una siringa temporizzata programmata su 12 ore (a causa della breve emivita di 3 minuti della somatostaina) con inizio serale dell’infusione, con la somministrazione intramuscolare di 20 mg di octreotide a lento rilascio ogni 20 giorni, consentendo la saturazione recettoriale e temporale. Un miglioramento della risposta terapeutica è stato ottenuto somministrando la somatostatina per via endovenosa anziché sottocutanea, sempre in 12 ore, utilizzando il temporizzatore. Il MDB, a differenza della concezione oncologica, sposta l’azione terapeutica dai meccanismi citolitici tossici e immunodepressivi al contrasto della crescita neoplastica, regolando negativamente il livello ematico di GH, che attiva l’oncogenesi attraverso molteplici meccanismi. [15, 264] Gli attuali paradigmi oncologici iniziano ad ammettere che il cancro può essere considerato una ricapitolazione patologica dei processi di crescita.
La somministrazione concomitante di Sodio Butirrato crea un contesto epigenetico di rilassamento della cromatina, essenziale nei processi di differenziamento. Le componenti differenzianti della MDB, come la soluzione di retinoidi in vitamina E, Vitamine C, D e Melatonina, contrastano quindi la capacità mutagena delle cellule tumorali, un vero e proprio sistema di difesa e programma di sopravvivenza che permette loro di riparare il danno al DNA indotto dalla chemio-radioterapia. Le prime forme di vita, i procarioti, sono sopravvissute fino ai giorni nostri perché, evolvendosi, si sono dotate di un sistema di difesa basato su un programma di mutazioni, che ha permesso loro di riparare i danni al DNA causati da vari eventi avversi. I procarioti hanno trasmesso il programma di sopravvivenza ai batteri, che a loro volta lo hanno trasferito alle cellule somatiche. Radman, un biologo molecolare, ha identificato e studiato questo programma di sopravvivenza e difesa trasferito dai procarioti agli eucarioti, e da questi ultimi alle cellule somatiche. Per le sue funzioni e lo scopo di sopravvivenza in condizioni di emergenza, lo ha chiamato il “programma SOS”, a cui le cellule somatiche accedono per superare situazioni critiche. [265]
Israel L. ha confermato che questi meccanismi di difesa sono attivati dalle cellule tumorali che attuano la stessa procedura dei germi, selezionando e conservando per ogni mutazione una serie di benefici in modo molto più rapido ed efficiente rispetto alle cellule batteriche. [266]
Le cellule tumorali in una situazione di stress acuto implementano sistemi di riparazione del DNA ed esprimono o silenziano i geni in base alle loro esigenze, selezionando e conservando per ogni mutazione una serie di vantaggi in modo molto più rapido ed efficiente rispetto alle cellule batteriche. Israel ha studiato il sistema SOS, identificando numerose omologie genetiche tra cellule neoplastiche e batteriche. Il sistema SOS consente alle popolazioni neoplastiche di diventare progressivamente refrattarie a vari trattamenti oncoterapici attraverso riparazioni del DNA e ricombinazioni genetiche. Nel nostro organismo, in condizioni stabili e biologicamente equilibrate, il sistema SOS è silenziato e inattivo, bloccato da un repressore trascrizionale, la proteina LEX-A. Quando il DNA di una cellula somatica è gravemente danneggiato, per accedere al percorso di sopravvivenza SOS e riparare il DNA, la cellula disattiva il repressore trascrizionale LEX-A utilizzando il regolatore positivo REC-A. L’espressione di SOS avvia così una serie di mutazioni che riparano ma allo stesso tempo modificano il DNA, avviando il processo di cancerogenesi. La cellula, così mutata, inizia un’involuzione tumorale, selezionando e conservando continuamente, con una progressione predefinita dal programma SOS, una serie di vantaggi, come confermato da Lambert [267] e, più recentemente, altri autori, tra cui Russo [268] , che ha dimostrato che vari meccanismi contro le cellule tumorali, anche al di là della chemio e della radioterapia, come gli anticorpi monoclonali e gli inibitori delle vie di segnalazione mitogeniche del ligando come EGFR, VEGF, IGF1, FGF, ecc., possono attivare molto rapidamente il sistema SOS e un numero estremamente elevato di molteplici meccanismi di sopravvivenza.
I due obiettivi strategici della MDB, non ancora perseguiti dall’oncologia, sono l’inibizione angiogenica proliferativa-invasiva neoplastica mediante Somatostatina/Octreotide, analoghi agonisti DR2, insieme alla lotta contro la capacità mutagena del fenotipo neoplastico silenziando il sistema di sopravvivenza SOS attraverso i componenti distintivi del MDB, che, con la loro attività trofica, immunomodulante e antiossidante, migliorano la vitalità e l’efficienza delle cellule sane riducendo, contemporaneamente, l’efficienza, la vitalità e la funzionalità delle cellule neoplastiche. Le stesse molecole esercitano effetti opposti sulle cellule sane e neoplastiche. L’uso metronomico di dosi apoptotiche, non citotossiche in un contesto biologico sfavorevole alla vitalità, proliferazione e migrazione delle cellule neoplastiche, ne provoca lentamente ma progressivamente l’estinzione per apoptosi. In un tumore, anche le cellule staminali resistenti alla chemio-radioterapia svolgono un ruolo cruciale nel mantenimento della crescita del tumore e nell’inizio del processo metastatico. La chemioterapia e la radioterapia agiscono sulle cellule tumorali a proliferazione attiva, le “cellule che amplificano il transito tumorale”. Al contrario, le cellule staminali tumorali proliferano lentamente e non sono interessate da chemio e radioterapia. Per questo motivo, le attuali strategie terapeutiche non possono mantenere il controllo a lungo termine del processo tumorale.
Oggi, in assenza di valide alternative terapeutiche, i sarcomi sono caratterizzati da indici proliferativi e potenziale metastatico particolarmente elevati, con conseguente elevata mortalità.
Tre cause contribuiscono a questo drammatico fallimento terapeutico:
1. Totale insensibilità a tutti i protocolli oncologici di popolazioni di sarcomi costituite principalmente da cellule staminali tumorali su cui, al contrario, è stata dimostrata l’efficacia delle molecole MDB qui discusse.
2. Mancata somministrazione di melatonina.
3. Mancata somministrazione della somatostatina, inibitore fisiologico del GH (e dei relativi fattori di crescita) e, quindi, della proliferazione e disseminazione neoplastica.
Il MDB, estendendo la propria attività di contrasto alle molteplici reazioni vitali della biologia neoplastica, sposta l’asse terapeutico da una pura concezione citotossico-citolitica e dall’illusoria e utopistica eradicazione di tutte le cellule tumorali, alla graduale riconversione fisiologica delle funzioni vitali deviate da il cancro, al recupero dell’omeostasi immuno-neuroendocrina, al differenziamento delle cellule tumorali e alla riprogrammazione delle cellule staminali tumorali. Non esiste (o esisterà mai) nessun trattamento chemioterapico citotossico (o monoterapia) in grado di guarire un tumore solido. Esiste solo un metodo, una multiterapia razionale e biologica, un complesso di sostanze sinergiche e fattorialmente interattive, individualmente dotate di attività antitumorale non tossica, che agiscono in modo sequenziale o simultaneo sulle miriadi di reazioni biologiche della vita tumorale, riportando gradualmente alla normalità la reazioni vitali alterate dal cancro.
Abbreviazioni
ATRA – Acido tutto trans retinoico
CCK – Colecistochinina
C.M. – Chemiotassi dei monociti indotta da GH
CSC – Cellule staminali del cancro
MDB – Metodo Di Bella
EGF – Fattore di crescita epidermico
EGFR – Recettore del fattore di crescita epidermico
FGF – Fattore di crescita fibroblastico
GF – Fattore di crescita
GH – Ormone della crescita
GHR – Recettore dell’ormone della crescita
HDAT – Istone deacetilasi
HGF – Fattore di crescita degli epatociti
HIF-1α – Fattore oncogenico inducibile dall’ipossia 1-alfa
IGF1-2 – Fattore di crescita simile all’insulina 1-2
IGFR – Recettore del fattore di crescita insulino-simile
IL8 – Interleuchina 8
MRI – Imaging a risonanza magnetica
MLT – Melatonina
NGF – Fattore di crescita dei nervi
NHL – Linfoma non Hodgkin
eNOS – Sintasi ossido nitrico endoteliale
PDGF – Fattore di crescita derivato dalle piastrine
PET – Tomografia a emissione di positroni
PG2 – Prostaglandine 2
PRL – Prolattina
PRLR – Recettore della prolattina
NMR – Risonanza Magnetica Nucleare
SSN – Servizio Sanitario Nazionale
SST – Somatostatina
SSTR – Recettore della somatostatina
TGF – Fattore di crescita trasformante
TRK – tirosin-chinasi
VEGF – Fattore di crescita endoteliale vascolare
VIP – Peptide intestinale vasoattivo

Commenti disattivati